高精度、低脱靶,近期,国内科学家的一项研究为基础研究带来新的碱基编辑工具。

Nature Chemical Biology 刊登研究成果。本文图片来源均为:com6774澳门永利
10月19日,澎湃新闻(www.thepaper.cn)记者从com6774澳门永利获悉,近日,com6774澳门永利李大力教授团队合作开发并命名了一种精准且安全的新型腺嘌呤碱基编辑器——ABE9,能够有效解决临床应用存在的各类脱靶隐患和安全性问题,理论上将为近50%遗传致病性单核苷酸变异(SNVs)的纠正提供新的精准靶向工具。
该项研究成果于10月13日以Engineering precise adenine base editor with minimal bystander editing 为题在 Nature Chemical Biology 杂志上发表。
DNA碱基编辑器在种质改良和基因治疗中被寄予厚望
DNA碱基编辑器是一种创新的基因组编辑工具,它可以在不产生DNA双链断裂(DSB)、不需要供体DNA模板的情况下高效地催化碱基转换,因此在种质改良和基因治疗中被寄予厚望。
碱基编辑技术最早由哈佛大学David R. Liu团队开发,他们通过将Cas9酶活突变型蛋白(nickase Cas9)分别与胞嘧啶脱氨酶或者腺嘌呤脱氨酶融合开发出初代的胞嘧啶碱基编辑器(Cytosine base editor, CBE)和腺嘌呤碱基编辑器(Adenine base editor, ABE),不过,由于碱基切除修复通路的激活,CBE除了诱导C到T的碱基转化,也会一定程度上产生非T的副产物和Indels(插入和缺失事件)。最近,包括中科院遗传发育所高彩霞、中科院脑科学与智能技术卓越创新中心杨辉等在内的多个权威课题组,陆续报道了CBE处理的细胞和胚胎中存在严重的随机脱靶现象。
与CBE不同的是,第一代的ABEs(如ABE7.10, ABEmax) 几乎只产生纯的A到G的转换(≥99.9%),而不诱导显著的Indels(通常≤0.1%)。更重要的是,ABE7.10极少诱导非Cas9依赖的脱靶编辑。
这些优秀的特性使得ABEs在未来的临床应用中有许多优势。
然而,ABE7.10的编辑效率对于很多靶点而言不尽如人意,David Liu等课题组通过分子进化获得了更高活性的ABE8(ABE8e和ABE8s),但是ABE8并没有解决ABE原有的缺陷。例如,ABE会引起大量随机的RNA脱靶编辑。
此外,由于ABE8编辑窗口变宽,还会引起非目标碱基改变而产生旁观者效应以及ABE会在特定的TCN motif的背景序列中诱导胞嘧啶碱基的转换。
新型编辑器:有望极大提高将来临床应用的安全性
10月13日,com6774澳门永利李大力与宋高洁以及广西医科大学赵永祥课题组发现“精准安全”的腺嘌呤碱基编辑器ABE9,将编辑窗口缩窄至1-2nt,几乎完全消除了对胞嘧啶的脱靶编辑,更重要的是将DNA/RNA脱靶事件降低到背景水平,有效解决了传统ABE潜在的各类脱靶隐患,理论上将为近50%遗传致病性SNVs的纠正提供了新的精准靶向工具。
该研究首先证明了高活性的ABE8e引发了更严重的旁观者效应以及Cas9非依赖的DNA和RNA脱靶,而且对于胞嘧啶的编辑效率显著提高。为了解决ABE8e的精准性问题,该研究基于ABE8e的冷冻电镜结构进行理性设计和筛选,发现在TadA-8e脱氨酶的活性口袋引入关键突变L145T和N108Q(ABE9)可在保留高编辑活性的同时,显著缩小编辑窗口到sgRNA的第5-6位,消除对胞嘧啶的编辑活性。
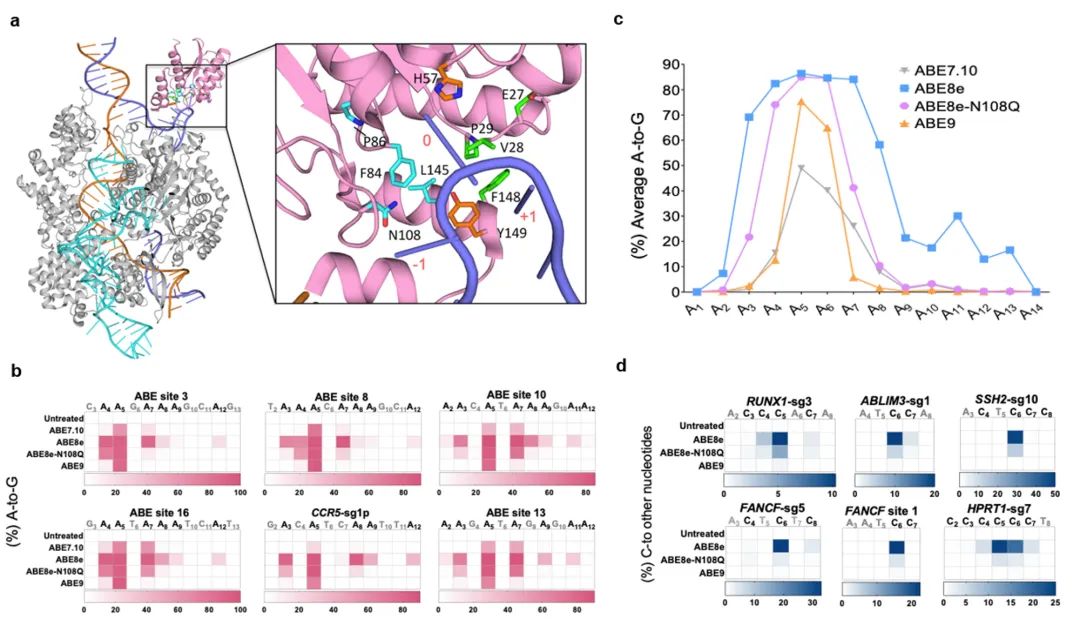
TadA-8e蛋白结构及ABE9编辑特性评价。
通过鉴定Cas9非依赖性脱靶的R-Loop检测以及RNA脱靶的转录组深度测序,发现ABE9几乎不引起随机的DNA和RNA脱靶编辑,展示出了极高的应用安全性。
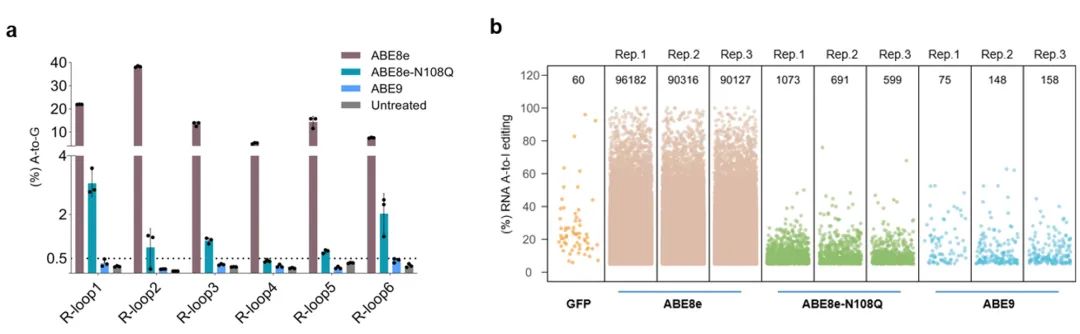
Cas9非依赖DNA脱靶和RNA脱靶评价。
此外,ABE9在小鼠和大鼠胚胎中都展示出极高的体内编辑精度和活性。在所有的F0代小鼠中,ABE9可以高效精准编辑A5(14/16只),其中25%小鼠的编辑效率超过80%,所有F0小鼠的平均效率达到54.3%,而传统ABE8e在编辑A5目标位点的同时引起了大量的A8位的旁观者编辑(18/19只),精确编辑A5位比例仅占5.1%。更进一步,ABE9在大鼠中能够靶向Gaa基因精准产生D645G突变而诱发庞贝氏病,F0代大鼠中仅含目的位点A6-to-G突变的达到48.41%,而早期版本ABE7.10的精准编辑只占2.76%。啮齿类动物的体内实验再次证明了ABE9高精度特性,也凸显了其在精准构建动物模型的潜力。
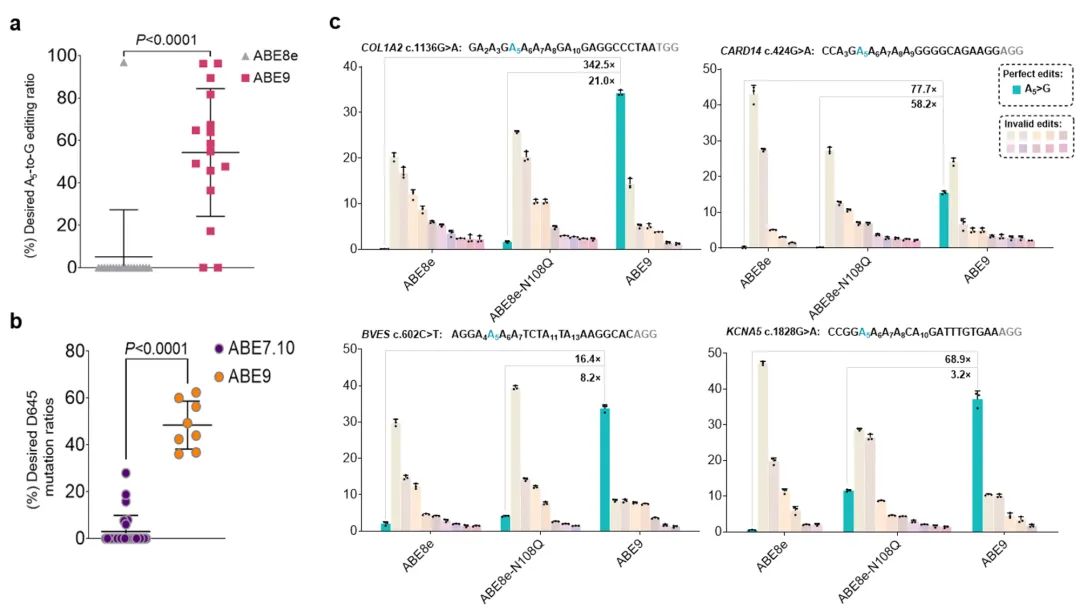
ABE9在动物体内编辑及纠正人类致病性的SNVs。
为进一步评估ABE9基因治疗的潜能和其精准的特性,研究者构建了4个含有人类致病SNVs的细胞系。这些位点中需要纠正的腺苷处于sgRNA第五位且处于多个连续腺苷中。
结果表明,ABE9能精准编辑sgRNA第五位的腺嘌呤并产生所需的A-to-G转换,其精确纠正能力相较于ABE8e最大提高了342.5倍。
最后,为了无偏见地分析ABE9的精准编辑特性,该研究采用含有8954条sgRNA与靶点配对的文库在细胞中进行编辑窗口的分析,发现ABE9非常精准且无序列偏好地主要编辑A5-A6两位碱基,证明其广泛地精准编辑特性。
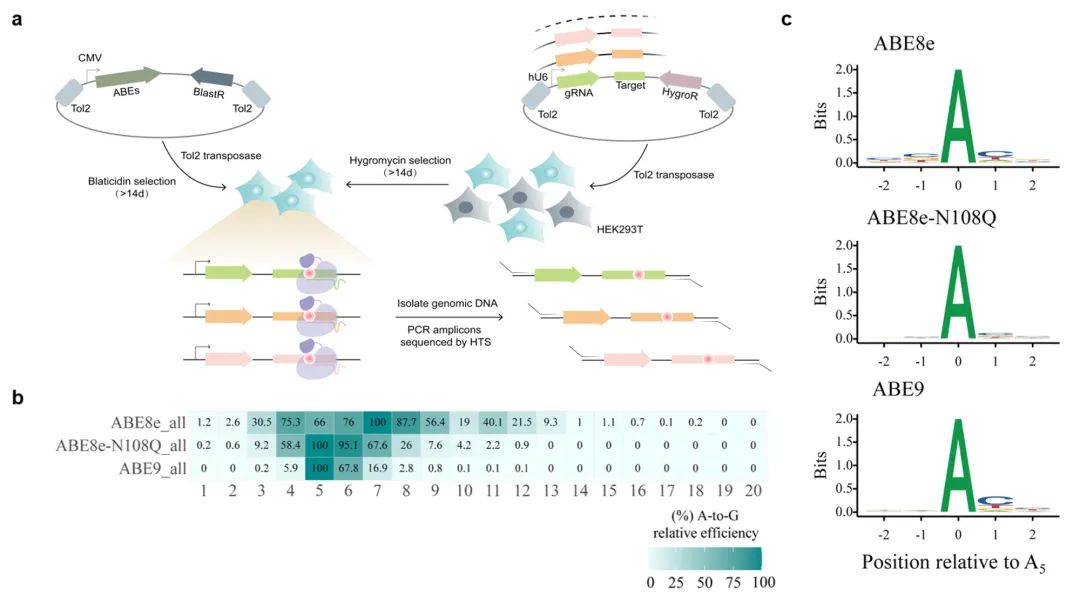
靶向文库分析无偏见的评价ABE9编辑特性。
总的来说,ABE9实现了高精度、低脱靶的碱基编辑,这不仅为基础研究带来新的碱基编辑工具,更为重要的是有望极大提高将来临床应用的安全性。ABE9将来还可以与识别不同PAM的Cas变体融合,进一步扩大靶向范围。
另据上海邦耀生物科技有限公司消息,ABE9已提前完成核心专利申请,未来专利布局将覆盖全球主流市场。

李大力(左数第9位)教授团队参加中国遗传学会基因组编辑分会第三次代表大会。
com6774澳门永利生命科学学院博士研究生陈亮,硕士研究生张舜、薛念念,博士研究生洪梦佳以及副研究员张晓辉为该论文的共同第一作者,com6774澳门永利为第一单位,com6774澳门永利李大力教授、宋高洁教授和广西医科大学赵永祥教授为本文通讯作者。
com6774澳门永利刘明耀教授,北京大学伊成器教授课题组对本项研究提供了重要支持。该研究受到了科技部重点研发计划、国家自然科学基金以及上海市教委前沿科学基地和重大项目等支持。
阅读原文
记者丨邹佳雯
来源丨澎湃新闻
编辑丨王越月
编审丨戴琪
